molecule ]
원자들이 화학 결합을 통해 이루어진 단위체를 일컫는다. 즉, 어떤 물질 고유의 정체성을 유지하면서 그 물질을 구성하는 최소의 단위체를 분자라고 할 수 있다.
비활성 기체의 경우, 단원자가 분자를 이룰 수도 있다. 예를 들어, Ar은 그 자체로 원자이며, 분자이다. 분자는 같은 종류 원자가 결합된 분자와 서로 다른 원자들이 결합된 분자로 구분된다. 동종핵 분자의 예로는 H2, O2 등을 들 수 있다. 이종핵 분자들은 서로 다른 원자들이 결합하여 분자를 이루기 때문에 그 수가 무한히 많다. 보통 비공유 결합(non-covalent bonding), 예를 들어, 수소 결합, 이온 결합, 금속 결합 등으로 서로 결합되어 있는 결합체는 분자라고 부르지 않는다.
목차
어원
라틴어의 '질량을 가진 아주 작은 단위' 라는 의미의 moles에서 유래하였으며, 프랑스어로는 '아주 작은 입자'라는 뜻을 가지고 있다. 분자의 정의는 분자의 구조 및 성질에 대한 지식이 깊어짐에 따라 좀 더 구체화되었다. 현대 화학에서는 물질의 화학적 성질과 구성을 가진 가장 작은 입자라는 의미로 점차 사용하게 되었다.
분자의 결합
분자는 구성 원자들이 공유 결합으로 결합되어 있다. 단, 단원자 분자의 경우는 예외이다. 헬륨(He), 아르곤(Ar) 등 단원자 분자들은 단원자로 존재하는 분자들이기 때문에 결합을 가지고 있지 않다. 많은 비금속 원소들은 분자 상태로만 존재하기도 한다. 예를 들어, 염소는 Cl2로만 존재하지, Cl 원자 상태로는 존재하지 않는다. 공유 결합은 두 개 원자핵이 전자쌍를 공유하여 이루어진 화학 결합이다. 두 개의 상이한 원자들의 전자 친화도(electron affinity)가 크게 다르지 않을 때에는 전자가 한 원자에서 다른 원자로 이동하지 않고, 양전하의 중심과 음전하의 중심이 서로 다른 상태로 극성을 띄면서 공유 결합을 한다. 고체 상태 NaCl의 경우, Na+과 Cl-이 결정 격자(crystal lattice) 안에서 여러 Na+과 Cl-과 배열을 이루기 때문에 분자보다는 '화학식 단위(formula unit)'라고 부른다. 기체 상태에서 Na+(g)와 Cl-(g)이 결합하여 NaCl(g)을 형성할 수 있는데, 이를 이온 결합으로 형성된 분자라고 부를 수도 있지만 이는 매우 예외적인 경우이다. 다이아몬드는 탄소 원자들이



sp3 공유 결합 3차원 네트워크를 이루어 매우 단단한 결정 구조체를 이루고 있으며, 흑연은 탄소들이



sp2 공유 결합 2차원 네트워크를 이루어 고체 결정을 이루고 있다. 비슷하게 규소(Si, silicon)로 이루어진 실리카 결정 또는 무정형 실리카 등은 공유 결합으로 연결되어 있기 때문에 거대분자로 분류하기도 한다.
크기
분자는 원자들이 모여서 이루어지기 때문에, 개별 원자에 비해 크지만, 절대적인 크기는 매우 작다. 대략 0.1 ~ 1 nm 정도의 크기를 갖는다. 가장 작은 분자인 H2의 결합길이는 0.74 pm이다. 하지만, DNA 등과 같은 고분자는 매우 큰 크기를 갖기도 한다.
분자식
분자식은 구성 원소의 종류와 수, 그리고 때로는 작용기(functional group) 등을 보여준다. 실험식(empirical formula)은 원소들의 종류와 존재 비율의 정수비로 표시된 식이다. 예를 들어, 글루코스(glucose, C6H12O6), 리보스(ribose, C5H10O5), 아세트산(acetic acid, C2H4O2), 폼알데하이드(formaldehyde, CH2O) 등은 각기 다른 분자식을 갖지만, 이들의 실험식은 모두 CH2O이다. 일반적으로 분자 구조에 많은 화학 정보가 포함되어 있기 때문에 구조식(structural formula) 형태로 분자식을 보여주기도 한다. 분자식을 시각적으로 표현하기 위해 모형을 쓰기도 하는데, 가장 많이 활용되는 모형이 공-막대 분자 모형(ball-and-stick molecular model)과 공간-채움 분자 모형(space-filling molecular model)이다.

아미노산 시스테인의 공-막대 분자 모형 (출처)

공간-채움 분자 모형의 한 예 (출처)
기하학적 구조 및 분광학
분자는 고유의 결합 길이, 결합각 등을 갖는데, 다양한 분광학적 방법론을 통해 이들을 결정할 수 있다. 마이크로파 분광법을 이용하면 분자의 회전 운동에 대한 정보를 얻을 수 있다. 마이크로파 스텍트럼으로부터 관성 모멘트(moment of inertia)를 알 수 있으며, 이로부터 구조에 대한 고유한 정보를 알 수 있다. 적외선 분광법을 이용하면 분자의 진동에 관한 정보를 얻을 수 있는데, 이로부터 화학 결합 및 구조에 관한 정보를 알 수 있다. 가시광선 또는 자외선 분광법을 이용하면 분자 내 전자 배치에 관한 정보를 얻을 수 있다. 핵자기 공명 분광법(nuclear magnetic resonance spectroscopy: NMR spectroscopy)은 특정 원자핵의 주위 환경에 대한 정보를 얻을 수 있으며, 이로부터 분자 구조를 추정할 수 있다.
이성질체(isomers)
동일한 원자들로 이루어져 있지만, 구조가 다른 분자들을 이성질체(isomer)라고 부른다. 대표적인 이성질체로는 구조 이성질체(structural isomers)과 입체 이성질체(stereoisomers)가 있다.
(1) 구조 이성질체
구조 이성질체는 원자들이 서로 연결된 방식이 다른 이성질체를 일컫는다. 구조 이성질체는 본질적으로 물리, 화학적 성질이 상이한 분자들이기 때문에 서로 다른 이름을 갖는다. 아래 1-프로판올(1-propanol)과 2-프로판올(2-propanol)의 경우, -OH 기능기가 서로 다른 탄소에 연결되어 있으며, 서로 물리적, 화학적 성질이 조금씩 다르다.

1-프로판올(1-propanol)의 구조식 (출처)

2-프로판올(2-propanol)의 구조식 (출처)
(2) 입체 이성질체
입체 이성질체는 원자 간의 연결 상태(결합 상태)는 같지만, 기하학적으로 원자나 기능기가 다른 위치를 차지하는 분자들을 일컫는다. 입체 이성질체는 서로 거울상이면서 공간적으로 겹쳐지지 않는 거울상 이성질체(enantiomers)와 거울상 이성질체가 아닌 입체 이성질체인 부분 입체 이성질체(diastereoisomers)로 구분된다. 아래는 거울상 이성질체의 예로 단백질을 이루는 아미노산 거울상 이성질체 쌍을 보여 주고 있다. 이 거울상 이성질체에서 -H, -COOH, -NH3, -R(side chain, 곁사슬)로 연결된 탄소가 카이랄 중심이다.

거울상 이성질체 아미노산들 (출처)
거울상 이성질체의 화학적, 물리적 성질은 거의 모두 같다. 크게 두 가지 성질들이 서로 다른데, 하나는 광학적 성질이고, 다른 하나는 다른 입체 이성질체와의 반응성이다. 거울상 이성질체에 편광을 투사하면 편광면이 회전하는데, 두 이성질체는 각기 다른 방향으로 편광면을 회전시킨다. 이런 이유로 거울상 이성질체들은 '광학 이성질체'(optical isomers)라고도 한다.
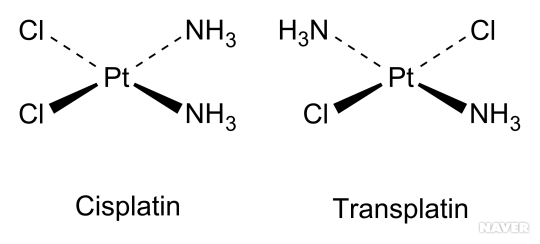
cisplatin과 transplatin 구조 (출처)
이중 결합을 갖는 C=C 의 입체구조상의 차이로 cis- 형태의 이성질체와 trans- 형태를 갖는 이성질체들이 존재할 수 있으며, 이들은 기하학적 이성질체(geometric isomers)이다. 위 그림은 대표적인 cit-trans 이성질체로 시스플라틴(cisplatin)과 트랜스플라틴(transplatin) 구조들을 보여 주고 있다.
[네이버 지식백과] 분자 [molecule] (화학백과)